丂丂丂丂丂丂丂丂丂丂丂丂丂拏慺懓尦慺偺幚尡
丂丂拏慺懓尦慺偼丄戞侾俆懓尦慺乮挿廃婜棩乯丄嘪乮俆乯懓尦慺乮抁廃婜棩乯丄僾僯僋僩僎儞乮拏慺傪彍偔乯丄偱偁傝丄拏慺乮N丄尨巕斣崋俈乯丄儕儞乮P丄尨巕斣崋侾俆乯丄僸慺乮As丄尨巕斣崋俁俁乯丄傾儞僠儌儞乮Sb丄尨巕斣崋俆侾乯丄價僗儅僗乮Bi丄尨巕斣崋俉俁乯丄摍 偱峔惉偝傟傞丅
丂丂戞侾俆懓尦慺偼壙揹巕偵 ns2np3 偺俆偮偺揹巕傪帩偮揹巕峔憿側偺偱丄拏慺偲儕儞偺壸揹巕偼 崿惉婳摴偺嫟桳寢崌傪帩偪丄堦曽丄僸慺丄傾儞僠儌儞丄價僗儅僗偼 嫟桳寢崌偲 嬥懏偲偟偰偺惈幙傪暪偣帩偮 敿嬥懏偱偁傝丄亄俁壙偲 亄俆壙偺巁壔悢偑埨掕偱偁傞丅
丂丂拏慺懓尦慺偺悈慺壔暔偼丄傾儞儌僯傾乮NH3乯丄儂僗僼傿儞乮PH3乯丄傾儖僔儞乮AsH3乯丄僗僠價儞乮SbH3乯偑懚嵼偟丄傾儞儌僯傾埲奜偼偡傋偰栆撆偱偁傞丅
丂丂侾丏丂拏慺偺幚尡丗
丂丂拏慺偼丄戞侾俆懓偱忢壏偱桞堦婥懱偺尦慺偱偁傞偺偼丄拏慺尨巕摨巑偺俁廳寢崌偵傛傞 嫮屌側寢崌椡偵傛傞偨傔偱丄拏慺暘巕乮N2乯偼 婓僈僗偵師偖晄妶惈側婥懱偵側偭偰偄傞丅 戞俀廃婜偺椬偺扽慺偑丄係杮偺嫟桳寢崌庤偵傛傞棫懱揑偱懡條側峔憿傪偲傝丄偡傋偰偺尦慺拞嵟崅偺梈揰乮徃壺揰 俁俇係俀亷乯偱丄僟僀儎儌儞僪偼乮帺慠暔偺拞偱乯嵟崅峝搙偱偁傝丄傑偨桳婡壔崌暔偼柍尷偺懡條惈傪帩偮偺偵懳偟偰丄旕忢偵懳徠揑偱偁傞丅丂桳婡壔崌暔偵壔妛揑偵擖偭偨拏慺偼丄扽慺偺懡條惈偺備偊偵丄懡條側曄壔傪偡傞丅乮傾儈僲婎丄僀儈僲婎丄僯僩儘婎丄僯僩儘僜婎丄傾僝婎丄僕傾僝婎丄丂僺儘乕儖娐丄僺儕僕儞娐丄僀儞僪乕儖娐丄僾儕儞娐側偳乯 摿偵丄惗暔懱傪峔惉偡傞暔幙乮傾儈僲巁丄僞儞僷僋幙丄峺慺丄妀巁丄丒丒丒乯偲偟偰廳梫側栶妱傪扴偭偰偄傞丅
丂丂儅儊壢偺怉暔偼崻釒僶僋僥儕傾偵傛偭偰 偨傫傁偔幙偺宍偱嬻拞拏慺傪屌掕偡傞丅
丂丂拏慺偺暒揰偼亅侾俋俆丏俉亷乮俈俈丏俁俇K乯乮梈揰 亅俀侾侽亷乯偱丄斀墳惈偵朢偟偄偙偲傗帒尮偑懡偔偁傝丄埨慡丒柍奞偱偁傞偙偲偐傜丄塼懱拏慺偼掅壏偺椻攠偵懡梡偝傟偰偄傞丅
丂丂傾儖僇儕嬥懏偺偆偪丄儕僠僂儉偺傒偑扨懱偺N2偲捈愙斀墳偡傞丅乮俇Li 亄 N2丂仺丂俀Li3N丄乮亖儕僠僂儉偺愗傝岥偑崟偔側傞偙偲乯丂Li3N 亄 俁H2O丂仺丂NH3 亄 俁LiOH乯
丂丂拏慺尨巕摨巑偺嫮屌側俁廳寢崌傪堷偒棧偡丄幚梡揑側壔妛斀墳偼丄嬻拞拏慺屌掕朄乮僴乕僶乕丒儃僢僔儏朄丒丒丒揝宯怗攠傪梡偄偰崅壏丒崅埑乮係侽侽乣俇侽侽亷丄俀侽侽乣侾侽侽侽倎倲倣偺挻椪奅棳懱忬懺乯偱悈慺偲斀墳偝偣 傾儞儌僯傾傪嶌傞曽朄乯丄偦偺傾儞儌僯傾傪敀嬥怗攠偱嬻婥巁壔偝偣徤巁傪摼傞曽朄乮僆僗僩儚儖僩朄乯丄 僇儖僔僂儉僇乕僶僀僪偲侾侾侽侽亷丒俀婥埑偱拏慺偲斀墳偝偣 僇儖僔僂儉僔傾僫儈僪乮旍椏乯傪嶌傞曽朄乮CaC2 亄 N2丂仺丂CaCN2 亄 C乯丄帴愇偱峀偘偨揹屖偱嬻婥傪斀墳偝偣堦巁壔拏慺乮NO乯傪嶌傝 悈傗愇奃偵媧廂偝偣偰徤巁丒徤巁墫傪嶌傞曽朄乮價儖働儔儞丒僄僀僨朄丄僲儖僂僃乕徤愇乯丄側偳丄偒傢傔偰尷傜傟偰偄傞丅丂摿偵僴乕僶乕丒儃僢僔儏朄偼拏慺旍椏偺戝検惗嶻傪傕偨傜偟丄俀侽悽婭偺擾嬈偵戝偄偵峷專偟偨丅
丂丂偛偔嵟嬤偵側偭偰丄偝傜偵掅僄僱儖僊乕壔偑壜擻側丄俆侽亷偱拏慺偲悈慺傪捈愙斀墳偝偣偰傾儞儌僯傾傪嶌傞 怗攠乮Ru乮儖僥僯僂儉乯乚CaFH乮悈慺壔僼僢慺壔僇儖僔僂儉乯乯偑奐敪偝傟偰偄傞丅乮搶岺戝丄俀侽俀侽擭乯
丂丂丒丂尨巕娫偺寢崌僄僱儖僊乕丗丂N佭N丂俋俀俉倠J/倣倧倢丄丂丂丂們倖丏丂俫亅俫丂係俁俀倠俰丄丂俫亅俶丂俁俉俇倠俰丄丂丂俠亅俫乮儊僞儞拞乯丂係侾俁倠俰丄丂丂俠亅俠丂俁俇俉倠俰丄丂俠亖俠丂俆俋侽倠俰
丂丂丂倕倶乯丂丂俶2乮倗倎倱乯丂亄丂俁 俫2乮倗倎倱乯丂仺丂俀 俶俫3乮倗倎倱乯丂丒丒丒丂傾儞儌僯傾偺惗惉擬丂亄俋俀倠俰/倣倧倢丄丂丂俶佭俶丂偺寢崌僄僱儖僊乕傪 倶 偲偡傞偲丄
丂丂丂丂丂丂丂丂俁俉俇 亊 俁 亊 俀丂亅丂乮倶 亄 係俁俀 亊 俁乯丂亖丂俋俀丄丂丂亪丂倶 亖 俋俀俉倠俰/倣倧倢丂丂丂丒丒丒丒丒丂偐側傝戝偒偄
丂丂丂們倖丏丂丂丂俫2乮倗倎倱乯丂亄丂侾/俀丂俷2乮倗倎倱乯丂亖丂俫2俷乮倗倎倱乯丂丂亄俀係俀倠俰/倣倧倢
丂丂丂丂丂丂丂丂丂俠乮倱倧倢乯丂亄丂侾/俀丂俷2乮倗倎倱乯丂亖丂俠俷乮倗倎倱乯丂丂亄侾侾侾倠俰
丂丂丒丂嬻婥拞偱偺崅揹埑曻揹偼丄拏慺偺僺儞僋怓丗
丂丂丂丂丂

丂丂乮侾乯丂拏慺僈僗偺敪惗丗
丂丂垷徤巁僫僩儕僂儉乮NaNO2丄俵亖俇俋丏侽乯 栺俀侽倗傪悈偵梟偐偟偰 栺俆侽倣倢偲偡傞丅 僼儔僗僐偵丄墫壔傾儞儌僯僂儉乮俶俫4俠倢丄俵亖俆俁丏俆乯 俀侽倗傪悈偵梟偐偟偰侾侽侽倣倢偲偟偨梟塼傪擖傟丄壐傗偐偵壛擬偟側偑傜 垷徤巁僫僩儕僂儉悈梟塼傪彮偟偢偮揌壓偡傞丅丂敪惗偡傞拏慺僈僗偼丄悈忋抲姺朄偱廤傔傞丅丂擱偊偝偟傗僠儍僢僇儅儞側偳傪擖傟傞偲壩偑徚偊傞丅
丂丂拏慺拞偱偼丄儅僌僱僔僂儉偼擱偊側偄偑丄儕僠僂儉偼擱從偡傞丅丂愗偭偨儕僠僂儉偺抐柺偼昞柺偑乮巁壔傛傝傕憗偔乯拏壔偟偰丄懍傗偐偵崟偔側傞丅挿帪娫乮悢擭乯宱偮偲儅僌僱僔僂儉傕崟偔側傞丅
丂丂丂丂丂NaNO2丂亄丂NH4Cl丂仺丂NH4NO2丂亄丂NaCl丄丂丂丂丂丂NH4NO2丂仺丂N2仾丂亄丂H2O
丂丂丂丂

丂丂乮俀乯丂嶰儓僂壔拏慺偺幚尡丗丂乮懡検偵嶌傜側偄帠丄 儓僂慺偺墝丒姺婥拲堄乯
丂丂尨巕忬偺拏慺俀屄偐傜 侾屄偺拏慺暘巕偑惗惉偡傞偲偒偺僄僱儖僊乕偑戝偒偄偙偲傪懱姶偡傞幚尡丅
丂丂儓僂慺乮I丄M亖侾俀俈丏侽乯乯 侾倗 偲 儓僂壔僇儕僂儉乮俲俬 丄俵亖侾俇俇丏侽乯 俀倗 傪 悈偵梟偐偟偰侾俆倣倢偺梟塼偲偟偰偍偔丅乮儓僂慺偼儓僂壔僇儕僂儉悈梟塼偵傛偔梟偗傞乯丂偙傟偵丄備偭偔傝偲丂俀俉亾傾儞儌僯傾悈乮俶俫3丄俵亖侾俈丏侽乯 俆倣倢乮夁忚検乯擖傟惷偐偵奾漚偡傞偲丄嶰儓僂壔拏慺丒傾儞儌僯傾偺崟妼怓偺捑揳偑偱偒傞偺偱丄傠夁偟偰廤傔傞丅乮捈愙丄擕敨偱傾儞儌僯傾悈偲儓僂慺傪嶤偭偰傕偱偒傞乯丂偙偺捑揳偑幖偭偰偄傞偆偪偵丄巻側偳偺忋偵丄揰忬偵晅偗丄傛偔姡偐偡丅
丂丂姡偄偨捑揳偼丄壛擬偼傕偪傠傫丄栻偝偠傗 塇側偳偑怗傟偰傕 敋敪偟偰丄戝偒側攋楐壒偲 儓僂慺偺墝傪弌偡丅乮彮偟偱傕幖偭偰偄傞偲敋敪偟側偄乯丂巆傝偺張暘偼丄擥傟偰偄傞偆偪偵棳偡偲帺慠暘夝偡傞丅
丂丂丂丂丂丂丂俇 NH3丂亄丂俁 俬2丂仺丂俶俬3丒乮NH3乯5伀丂亄丂俁 俫俬丄丂丂丂丂丂丂俶俬3丒乮NH3乯5丂仺丂俶俬3丒俶俫3丂亄丂係 NH3仾丂乮姡憞乯
丂丂丂丂丂丂丂俉 俶俬3丒俶俫3丂仺丂俆 俶2仾丂亄丂俇 俶俫4俬丂亄丂俋 俬2丂乮敋敪乯
丂丂丂

丂丂乮俁乯丂棸巁僸僪儔僕儞偺嶌惉丗丂乮姺婥拲堄乯
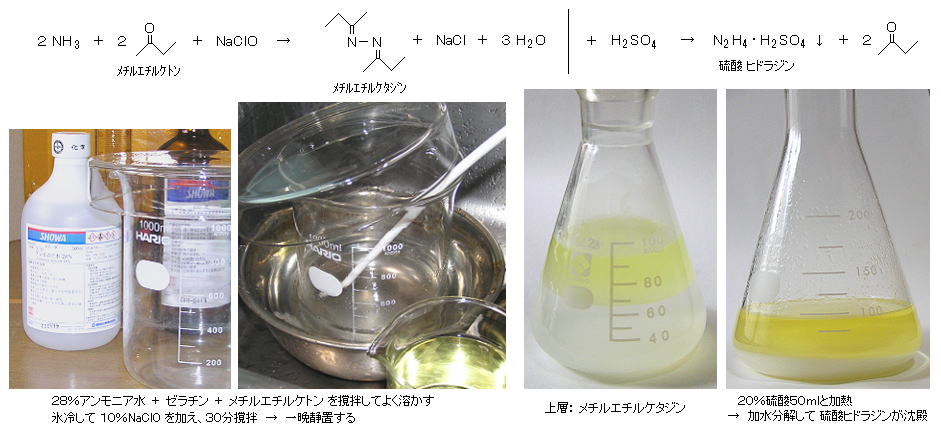
丂丂慜夞 侾俋丄俉丏偱擜慺偐傜棸巁僸僪儔僕儞傪嶌偭偨偑丄偙偙偱偼 傾儞儌僯傾偐傜 儊僠儖僄僠儖働僩儞傪捠偟偰丄棸巁僸僪儔僕儞乮俶2俫4丒俫2俽俷4丄俵亖侾俁侽丏侾丄倣倫丏俀俆係亷丄梟夝搙 俁倗/侾侽侽倣倢悈乯傪嶌惉偡傞丅
丂丂俀俉亾傾儞儌僯傾悈乮NH3丄M=侾俈丏侽乯 俀俆侽倣倢乮夁忚検乯 偵 侽丏俆倗偺僛儔僠儞乮悈偺擃壔嵻乯傪擖傟偰梟偐偟丄儊僠儖僄僠儖働僩儞乮俵俤俲丄俀乚僽僞僲儞丄俠2俫5丒俠俷丒俠俫3丄M=俈俀丏侾丄倐倫丏俈俋丏俇亷乯 侾侽侽倣倢 傪壛偊偰丄侾侽暘娫傛偔偐偒崿偤偰梟偐偡丅丂偙傟傪昘悈偵捫偗側偑傜丄侾侽亾 師垷墫慺巁僫僩儕僂儉乮俶倎俠倢俷丄桳岠墫慺侾侽亾丄擹搙偼擹偄傎偳椙偄丄俵亖俈係丏係乯 俀侽侽倣倢傪壛偊丄俁侽暘傎偳傛偔奾漚偡傞丅乮偁傞偄偼崅搙偝傜偟暡偱傕偱偒傞乯丂偙傟傪堦斢惷抲偟偰丄偱偒偨儊僠儖僄僠儖働僞僕儞傪晜偐傃忋偑傜偣傞丅
丂丂忋憌傪庢傝丄僗億僀僩偱 僼儔僗僐偵擖傟偨俀侽亾棸巁乮俫2俽俷4乯 栺俇侽倣倢偵壛偊丄俉侽亷掱搙偵壛擬偡傞偲丄棸巁僸僪儔僕儞乮俫2俶亅俶亄俫3丒俫俽俷4亅乯偺敀偄捑揳偑偱偒傞偺偱丄傠夁丒姡憞偡傞丅丂乮MEK偺戙傢傝偵傾僙僩儞偱傕偱偒傞偑丄傾僙僩儞傾僕儞偺棸巁偵傛傞暘夝偼抶偄乯丂廂検丗 栺侾侽倗
丂
丂丂俀丏丂儕儞偺幚尡丗
丂丂儕儞偵偼丄敀儕儞乮墿儕儞乮偍偆傝傫乯乯丒愒儕儞乮偣偒傝傫乯丒巼儕儞丒崟儕儞側偳偺摨慺懱偑偁傝丄偨偲偊偽愒椨傪姡棷偡傟偽墿椨偑偱偒丄墿椨傪俀俇侽亷乮暒揰偼俀俉侽丏俆亷乯偵俁亅俆擔抲偔偲丄愒椨偵側傞丅丂巼儕儞乮兛嬥懏儕儞乯偼 墧偵儕儞傪梟偐偟偰愅弌偝偣 偦偺屻墧傪徤巁偵梟偐偟偰彍偗偽 巆熢偵巆偭偰摼傜傟傞丅丂崟儕儞乮兝嬥懏儕儞乯偼丄侾俀侽侽侽婥埑丒俀侽侽亷偱摼傜傟傞丅
丂丂儕儞偦偺傕偺偺惢憿偼丄僇乕儃儞丒傾乕僋楩偱椨奃愇丄僐乕僋僗丄宂嵒傪侾係侽侽亷偵嫮擬丒姡棷偟偰峴傢傟傞丅丂乮幚尡幒偱偼嶌傝偵偔偄丂仺丂侾侽丏墿椨偺惗惉乯
丂丂亄俁壙丄亄係壙丄亄俆壙偺巁壔悢偑抦傜傟丄嶰墫壔儕儞乮PC倢3丄亄俁壙乯丄師垷儕儞巁乮儂僗僼傿儞巁丄HO丒PO丒H2丄堦墫婎巁乯丄垷儕儞巁乮俀壙偺巁丄H丒PO丒乮OH乯2丄亄俁壙乯丄屲巁壔擇儕儞乮俹2俷5丄亄俆壙乯丄儕儞巁乮PO丒乮OH乯3丄亄俆壙乯丄屲墫壔儕儞乮俹俠倢5丄亄俆壙乯側偳偑偁傞丅
丂丂擱從偡傞偲丄屲巁壔擇儕儞乮屲巁壔儕儞丄廫巁壔巐儕儞丄P4O10乯偺敀墝偑惗偠傞丅丂丂係 P 亄 俆 O2丂仺丂P4O10
丂丂墿儕儞偼丄壵惈傾儖僇儕悈梟塼偲斀墳偟偰丄儂僗僼傿儞乮PH3丄拏慺偺傾儞儌僯傾NH3偵憡摉乯傪惗偠傞丅乮儂僗僼傿儞偼栆撆乯丂偙偺斀墳偼丄愒椨惢憿偺嵺偵巆偭偨墿椨傪彍嫀偡傞偨傔偵梡偄傜傟傞丅崅弮搙偺儂僗僼傿儞偼丄敿摫懱惢憿帪偺僪乕僾嵽偵梡偄傜傟傞丅丂丂丂P4丂亄丂係 OH亅丂亄丂俀 H2O丂仺丂俀 HPO32亅丂亄丂俀 PH3仾
丂丂惗懱撪偱偼丄崪傗帟偺儕儞巁僇儖僔僂儉乮傾僷僞僀僩乯傗丄嵶朎丄恄宱嵶朎側偳偺儕儞帀幙偺懠偵丄妀巁乮DNA側偳乯偵偍偄偰廳梫側摥偒傪偡傞丅丂僰僋儗僆僔僪乮屲扽摐亄僾儕儞墫婎偐僺儕儈僕儞墫婎偑寢崌偟偨傕偺乯偲儕儞巁偑僄僗僥儖寢崌偟偨傕偺偑 僰僋儗僆僠僪偱丄儕儞巁偺俀杮偺寢崌庤偱屳偄堘偄偵偮側偑偭偨乮儂僗儂僕僄僗僥儖寢崌偟偨乯暔偑丄億儕僰僋儗僆僠僪丄偡側傢偪 妀巁偲側傞丅
丂丂怉暔偺搚忞偺俁戝塰梴慺偼丄拏慺丄儕儞丄僇儕僂儉偱偁傝丄偦偺偆偪偺儕儞巁暘偑 塰梴暘偺憤検傪寛傔傞乮亖棩懍偵側傞乯偲偄傢傟傞丅丂偨偲偊偽丄愻嵻偺攔悈摍偵傛傝儕儞巁偑憹偊傞偲丄憯椶偑堎忢敪惗偟偰乭愒挭乭側偳偲側傞偺偱丄攔悈拞偺慡儕儞暘偑婯惂偝傟偰偄傞丅乮拏慺丄僇儕僂儉偼婯惂偱偒側偄丅乯
丂丂乮侾乯丂墿儕儞偺嶌惉丗丂乮栆撆丒庢埖偄拲堄丄敪壩拲堄乯
丂丂愒椨乮P丄M亖俁侾丏侽丄徃壺揰 係俋侽亅俆俋侽亷丄兿俀丏俀乣俀丏俁俆乯 俆乣侾侽倗傪丄冇侾俆倣倣僈儔僗娗偺堦抂傪暵偠偰 傊偺帤偵嬋偘偨傕偺偵媗傔偰丄傕偆堦抂傪俆侽亷掱搙偺搾偺擖偭偨價乕僇乕偺悈柺偺彮偟壓偵捫偗丄僶乕僫乕偱忋偺曽偐傜擬偟偰愒椨傪偡傋偰姡棷偡傞丅 僈儔僗娗偺搑拞傕暿偺僶乕僫乕偱帪乆壏傔偰丄娗撪偺儕儞偺忲婥傗寢業偟偨傕偺傪捛偄弌偡傛偆偵偡傞丅 乮楻傟忲婥偑帪乆擱從偡傞偑婥偵偣偢嵟屻傑偱峴偆丅廔傢偭偨傜丄彮偟娗傪帩偪忋偘偰悈柺偐傜弌偡偲帺慠偵撪晹偵壩偑擖偭偰惷偐偵擱偊傞丅 嵟屻偵巊偭偨婍嬶偼偡傋偰壩偱從偄偰 帺慠敪壩偡傞墿椨傪巆偝側偄傛偆偵偡傞丅偁傞偄偼棸巁摵梟塼偵捫偗偰丄晄擱壔偡傞丅乯丂梟偗偨墿椨偼夁椻媝偡傞偺偱丄椻悈偵捫偗偰屌傑傜偣傞丅
丂丂墿椨偼僺儞僙僢僩摍偱埖偄丄嬻婥拞偵弌偡偲師戞偵敀墝傪忋偘丄偮偄偵偼寖偟偔擱偊傞偺偱丄價儞偵悈傪擖傟偰丄昁偢悈偵捑傔偰曐懚偡傞丅價儞偑妱傟側偄傛偆偵丄偝傜偵僇儞傗働乕僗偵擖傟偰偍偔偺偑朷傑偟偄丅
丂丂丂丒丒丒丒丒丂丂墿椨乮敀儕儞丄M亖俁侾丏侽丄倣倫丏係係丏俀亷丄倐倫丏俀俉侽丏俆亷丄兿侾丏俉俀丄擇棸壔扽慺丄儀儞僛儞偵梟乯
丂丂墿椨偼愄 桘帀偲楙偭偰乭偹偙偄傜偢乭乮僱僘儈庢傝乯偵巊梡偟偨丅乮埫強偱岝傞乯 偐側傝偺栆撆偱偁傞丅 弶婜偺儅僢僠偵梡偄傜傟丄撆惈偲壩帠偵側傝傗偡偄帠偐傜丄愒椨偺杸嶤柺偲 棸墿亄墫慺巁僇儕僂儉偺幉偱壩傪偮偗傞 埨慡儅僢僠偵愗傝懼偊傜傟偨楌巎偑偁傞丅 尰嵼偼丄俀侽俀俀擭俈寧偵擔杮偵偍偗傞堦斒偺儅僢僠偺惢憿偼廔椆偟偨丅乮埨壙側儔僀僞乕偵抲偒姺傢偭偰偄傞堊丄傑偨丄桝擖昳偵側偭偰偄傞丅摿庩側僉儍儞僾梡儅僢僠丄僒僶僀僶儖儅僢僠摍偼儅僌僱僔僂儉崌嬥傪巊梡丅乯丂儕儞偼媡偵晄擱嵽偺梡搑偑奐敪偝傟偰偄傞丅丂儕儞壔傾儖儈偼悈偲斀墳偟偰桳撆偺儂僗僼傿儞乮PH3乯傪敪惗偡傞偺偱丄嶦拵丒鄮忲嵻偵梡偄傜傟傞丅
丂丂丂

丂丂乮俀乯丂儓僂壔儊僠儖偺嶌惉丗丂丂桳撆丄姺婥拲堄
丂丂桳婡崌惉偺拞娫懱偲偟偰丄嶰墫壔儕儞乮PCl3乯傗 屲墫壔儕儞乮PC倢5乯側偳偺僴儘僎儞壔儕儞偑傛偔梡偄傜傟偰偄傞丅 偙偙偱偼丄愒椨乮斀墳偼斾妑揑壐傗偐乯偲 儓僂慺偱偱偒傞 嶰儓僂壔儕儞丄屲儓僂壔儕儞傪拞娫懱偲偟偰丄儊僞僲乕儖偐傜儓僂壔儊僠儖傪嶌惉偟偨丅丂儓僂壔儊僠儖偼丄儊僠儖壔嵻偲偟偰梡偄傜傟傞丅
丂丂愒椨乮P丄M亖俁侾丏侽乯 俆倗乮夁忚検乯丄 儓僂慺乮俬丄俵亖侾俀俇丏俋丄倣倫丏侾侾俁丏俈亷乯 俆侽倗乮侽丏係侽倣倧倢乯傪丄崿偤側偄傛偆偵偟偰 僼儔僗僐偵擖傟傞丅 僼儔僗僐傪昘悈偱椻傗偟側偑傜丄儊僞僲乕儖乮俠俫3俷俫丄俵亖俁俀丏侽丄倐倫丏俇係丏俈亷丄兿侽丏俈俋乯 侾俇丏俀倣倢傪備偭偔傝揌壓偡傞丅 儓僂慺偲愒椨偑寖偟偔斀墳偡傞偺偱丄儓僂慺忲婥偑楻傟弌側偄傛偆偵 慡懱傪傛偔椻傗偡丅寖偟偄斀墳偑廂傑偭偨傜丄壛壏偟偰忲棷偡傞丅乮懡偔偺儓僂慺偑楻傟弌偰偟傑偭偨傜丄斀墳廔椆屻偵丄傕偆堦搙揌壓楻搇偵栠偟偰 嵞忲棷偡傞丅乯
丂丂棷暘偼丄儓僂慺傗巁偑崿偠偭偰偄傞偺偱丄侾侽亾掱搙偺扽巁僫僩儕僂儉偲僠僆棸巁僫僩儕僂儉偺崿崌梟塼偲怳偭偰愻偄丄壓憌傪 柍悈墫僇儖偺擖偭偨僼儔僗僐偵擖傟偰悈暘偲儊僞僲乕儖傪彍偔丅
丂丂傠夁丒嵞忲棷偟偰丄妼怓傃傫偵擖傟偰曐懚丅乮岝偱儓僂慺傪弌偟妼怓偵側傞乯丂丒丒丒丒丂儓僂壔儊僠儖乮儓乕僪儊僞儞丄俠俫3俬丄俵亖侾係侾丏俋丄倐倫丏係俀亷丄兿俀丏俀俉乯
丂丂丂丂丂侾侽 CH3OH丂亄丂俀 P 亄 俆 I2丂仺丂侾侽 CH3I仾丂亄 俀 H3PO4 亄 俀 H2O
丂

丂丂乮俁乯丂儕儞巁偺専弌丗
丂丂儌儕僽僨儞巁偵傛傞 儕儞巁偺専弌丒敿掕検偺幚尡傪偡傞丅乮帋椏丗丂奀悈丄屛悈丄僐乕儔側偳偺怘昳揧壛暔丄愻嵻丂摍丄偁傜備傞怘昳暘愅丄娐嫬暘愅乯
丂丂儕儞巁堦僇儕僂儉乮儕儞巁擇悈慺僇儕僂儉丄KH2PO4丄M亖侾俁俇丏侾丄儕儞暘俹乮俵亖俁侾丏侽乯乯 侾丏俈俇倗傪 悈偵梟偐偟偰侾侽侽倣倢偲偟丄偙偺侾侽倣倢傪儂乕儖僺儁僢僩偱検傝庢傝 悈偱敄傔偰侾侽侽倣倢偵偡傞丅偙傟傪俀攞偵婓庍偡傞偲丄丂儕儞俹 偲偟偰丂侽丏俀倣倗/倣倢 偺梟塼偑偱偒傞丅丂偝傜偵丄侾/侾侽丄侾/侾侽侽 偵婓庍偟偨梟塼傪梡堄偡傞丅
丂丂丒丂儌儕僽僨儞巁傾儞儌僯僂儉乮乮俶俫4乯6俵倧7俷24丒係俫2俷丄俵亖侾俀俁俆丏俋乯 侽丏俆倗傪俇倣倢偺悈偵梟偐偟丄侾丗侾棸巁乮俫2俽俷4乯 俁倣倢傪壛偊偰傛偔崿偤偰偍偔丅
丂丂丒丂僴僀僪儘僒儖僼傽僀僩乮俶倎2俽2俷4丄俵亖侾俈係丏侾乯 偺栺侾侽亾悈梟塼傪嶌偭偰偍偔丅乮娨尦嵻仏丂晛捠偼傾僗僐儖價儞巁娨尦朄偱峴偆乯
丂丂俹 偑丄侽丏俀倣倗/倣倢丄 侽丏侽俀倣倗/倣倢丄 侽丏侽侽俀倣倗/倣倢 偺偦傟偧傟偺儕儞巁乮仏仏乯梟塼傪帋尡娗偵庢傝丄儌儕僽僨儞巁傾儞儌僯僂儉塼偲 僴僀僪儘僒儖僼傽僀僩梟塼傪 侾乣俀揌壛偊傞偲丄儌儕僽僨儞丒僽儖乕偺惵怓偑尰傢傟傞丅丂乮杮棃偼偙偙偱丄斾怓娗偵擖傟丄暘岝岝搙寁偱掕検偡傞乮兩亖俉俀俁値倣乯丂丒丒丒丂偁傜偐偠傔昗弨塼偱専検慄傪嶌傞乯
丂丂仏丂娨尦嵻偲偟偰丄傾僗僐儖價儞巁乮侽丏侾倣倧倢/倢乯丄偁傞偄偼丄垷棸巁僫僩儕僂儉乮侾侽亾乯亄僸僪儘僉僲儞乮侽丏俆亾乯傪梡偄偰傕椙偄丅
丂丂仏仏丂慡儕儞傪掕検偡傞偨傔偵偼丄慜張棟偱丄拏慺丒儕儞應掕梡偺儁儖僆僉僜擇棸巁僇儕僂儉乮係倗/侾侽侽倣倢乯偱丄乮儂僗僼傿儞丄垷儕儞巁側偳傪乯偡傋偰儕儞巁偵巁壔偟偰偐傜丄儌儕僽僨儞巁朄偱掕検偡傞丅
丂丂丂丂

丂丂俁丏丂僸慺偺幚尡丗丂丂栆撆拲堄
丂丂僸慺乮徨慺丄As丄M=俈係丏俋乯 傕丄儕儞偲摨條偵丄奃怓僸慺乮嬥懏僸慺丄俇侾俆亷徃壺乯丄墿怓僸慺乮廮傜偐偄丒僯儞僯僋廘乯丄崟怓僸慺丄巐僸慺 偺係偮偺摨慺懱偑偁傞丅
丂丂僸慺傕僸慺壔崌暔傕栆撆偱丄屆戙儘乕儅偺愄偐傜乮僸僜偐偵丠乯撆嶦梡偵梡偄傜傟偰偒偨丅偡偖偽傟傞偺偱丄乭嬸幰偺撆乭偲傕尵傢傟傞丅丂乮僸慺傪娷傓暔幙傪栘扽暡偲嫟偵傞偮傏偵擖傟偰擬偡傞偲丄儖僣儃偺奧偵乽僸慺嬀乿偑偱偒傞乯
丂丂僸慺偺悈慺壔暔 傾儖僔儞乮AsH3乯偼栆撆丅丂崅弮搙偺傕偺偼敿摫懱偺僪乕僺儞僌嵻偵梡偄傜傟丄傑偨 僸壔僈儕僂儉乮僈儕僸僜丄GaAs乯側偳偺嬥懏娫壔崌暔偼敿摫懱慺巕偵梡偄傜傟偰偄傞丅
丂丂僸慺偺撆惈偼丄傕偭傁傜 傾儈僲巁偺僔僗僥僀儞偺-SH 婎側偳偵寢崌偟偰峺慺偺婡擻慾奞傪偍偙偡偙偲偵傛傞偑丄儕儞偵惉傝戙傢偭偰 惗懱撪偺戙幱慡斒偵偐偐傢傞丅丂偦偺撆惈傪棙梡偟偰丄乮柍悈乯垷僸巁乮As2O3乯丄垷僸巁僇儖僔僂儉側偳偑嶦憀嵻傗僔儘傾儕嬱彍側偳偵梡偄傜傟偰偒偨丅乮桳撆尦慺丄僞儕僂儉偼僇儕僂儉偵丄僙儗儞偼棸墿偵 惉傝戙傢偭偰奞傪媦傏偡乯丂僔儘傾儕丄僑僉僽儕側偳偺崺拵偵偼丄拵偵偩偗扙悈岠壥偺偁傞丄儂僂巁丄犴嵒偑埨慡偱傛偔岠偔丅
丂丂偟偐偟堦曽偱丄僸慺偼旝検昁恵尦慺偱偁傝丄傑偨丄僸慺偺桳婡壔崌暔偺拞偵偼柍撆偺傕偺偑懚嵼偟丄僒儖僶儖僒儞乮儁僯僔儕儞埲慜偺攡撆偺栻丄擔杮恖偑奐敪乯偑梡偄傜傟偰偒偨丅
丂丂乮侾乯丂僸巁僇儖僔僂儉偺嶌惉丗
丂丂垷僸巁偼丄僸慺傪擱從偡傞 墝摴撪偵偱偒傞偺傪嵦庢偡傞偑丄幚尡幒揑偵嶌傝偵偔偄偺偱丄僸慺傪擹徤巁偵梟偐偟偰 僸巁乮H3AsO4乯傪嶌傞曽朄偱峴側偭偨丅乮儕儞偺丄惓儕儞巁乮僆儖僩儕儞巁乯 H3PO4 偵憡摉乯丂僸巁傕丄垷僸巁偵師偖栆撆偱偁傞丅
丂丂奃怓僸慺乮As丄棻忬乮夠忬乯丄M=俈係丏俋乯 俀倗 偵丄擹徤巁乮俫俶俷3丄俵亖俇俁丏侽丄俇侽亾丄兿侾丏俁俉乯 侾侽丏俀倣倢 傪壛偊丄壛擬偟偰梟偐偡丅乮擇巁壔拏慺敪惗丂仺丂攔婥乯
丂丂悈巁壔僫僩儕僂儉乮NaOH丄M=係侽丏侽丄俋俈亾乯 俁丏俁倗傪悈栺俀侽倣倢偵梟偐偟偨傕偺偱拞榓偟丄僸巁僫僩儕僂儉悈梟塼偲偡傞丅乮傕偟徤巁偑梋傟偽丄傾儞儌僯傾偱挷惍乯
丂丂偙傟偵丄墫壔僇儖僔僂儉乮CaCl2丄M=侾侾侾丏侽乯 俁倗乮夁忚検乯偺悈梟塼傪奾漚偟側偑傜壛偊偰丄悈偵晄梟惈偺僸巁僇儖僔僂儉乮俠倎3乮俙倱俷4乯2丄俵亖俁俋俉丏侾乯傪捑揳偝偣傞丅 怗傜側偄傛偆偵拲堄偟偰丄傠夁丒悈愻乮俁夞乯丒姡憞乮晽姡亄僨僔働乕僞乕乯偡傞丅棻偼慹偔寢徎幙側偺偱丄傠夁丒姡憞偟傗偡偄丅丂丂乮丂丒丒丒丒丒丂幚尡屻丄僸慺偱墭愼偝傟偨傠巻側偳偼丄墭愼偑奼嶶偟側偄傛偆偵丄僙儊儞僩偱屌傔 掚偺曅嬿側偳偵杽傔偰偍偔乯
丂丂丂丂丂As丂亄丂俆 HNO3丂仺丂H3AsO4丂亄丂俆 NO2仾丂亄丂H2O丄丂丂丂丂俀 Na3AsO4丂亄丂俁 CaCl2丂仺丂Ca3乮AsO4乯2伀丂亄丂俇 NaCl
丂

丂丂係丏丂傾儞僠儌儞偺幚尡丗
丂丂傾儞僠儌儞乮Sb丄M=侾俀侾丏俉丄倣倫丏俇俁侽丏俇亷丄兿俇丏俈侽乯偼丄忢壏忢埑偱埨掕側偺偼 嬧敀怓偺峝偔偰傕傠偄奃怓傾儞僠儌儞偱偁傞丅 嬥彴偱嵱偒丄擕敨偱梕堈偵暡枛偵偡傞偙偲偑偱偒傞丅丂愄偐傜丄妶帤崌嬥傗 傾儞僠儌僯乕偲偄偆拻暔梡偵丄墧偲僗僘偲偺崌嬥偲偟偰梡偄傜傟偰偒偨丅 擔杮嶻偺婸埨峼乮Sb2S3乯偼峼暔偲偟偰桳柤偱偁傞偑丄帒尮偲偟偰偼拞崙偺屛撿徣偑庡側嶻抧丅
丂丂尰嵼偺嵟戝梡搑偼丄俇侽亾偑嶰巁壔傾儞僠儌儞乮俽倐2俷3乯偺宍偱擄擱嵻偲偟偰僾儔僗僠僢僋摍偺僐儞僷僂儞僪偲偟偰梡偄傜傟偰偄傞丅丂俀侽亾偑墧拁揹抮梡丄懠 偡傋傝幉庴偗崌嬥梡丅丂崅弮搙偺僗僠價儞乮SbH4丄栆撆乯傗僴儘僎儞壔傾儞僠儌儞偼 敿摫懱偺僪乕僾梡偵丄摿偵 嶰儓僂壔傾儞僠儌儞偼丄僥儖儖乚價僗儅僗宯 儁儖僠僃慺巕偺僪乕僾偵巊傢傟偰偄傞丅
丂丂乮侾乯丂傾儞僠儌僯乕崌嬥偺嶌惉丗
丂丂傾儞僠儌僯乕偼丄墧丂俉侽亅俋侽倵倲亾丄 僗僘丂俀亾掱搙丄 傾儞僠儌儞丂侾侽亅俀侽亾丂掱搙偺妱崌偺崌嬥偱丄棳摦惈偑椙偔拻憿偟傗偡偔丄偦偺屻偺儊僢僉傕偟傗偡偄偺偱丄彫嶮丒僩儘僼傿乕丒儊僟儖側偳偺彫暔偑嶌傜傟偰偄傞丅丂乮墧侾侽侽亾側傜偽嬅屌帪偵俁丏係係亾廂弅丄傾儞僠儌儞侾侽侽亾偱 侽丏俋俆亾朿挘丄丂傾儞僠儌儞俈俆亾乚墧俀俆亾偱 懱愊朿挘棪偼侽亾偲側傞丅乯
丂丂梈揰亖嬅屌廔椆壏搙偼 俀俀侽乮Sb侾侽亾乯亅俀俆侽亷乮Sb侾俆亾乯丅嶌嬈壏搙偼偳偪傜傕俀俈侽亷丅
丂丂墧乮Pb丄倣倫丏俁俀俈丏俆亷丄兿侾侾丏俁係乯 俉俁倗丄 僗僘乮庎丄俽値丄倣倫丏俀俁侾丏俋亷丄兿俈丏俀俈乯 俀倗丄 傾儞僠儌儞乮Sb丄倣倫丏俇俁侽丏俇亷丄兿俇丏俈侽乯 侾俆倗 傪丄僔儕僇働乕僗偵擖傟偨崟墧傞偮傏偵擖傟丄崅廃攇楩乮係俈丏崅廃攇楩偺幚尡乮俁乯 偺俀丏乯偱壛擬丒梟夝偟偨丅 傾儞僠儌儞偼崅梈揰偺偨傔梟偗偵偔偄偺偱丄僗僥儞儗僗偺朹偱傛偔奾漚偟偰 奆梟偗偨丅丂梟夝屻丄崟墧宆偵棳偟崬傫偱彫僽儘僢僋傪嶌偭偨丅 廂弅棪偑彫偝偄偺偱丄墧傗傾儖儈丄垷墧側偳傛傝傕 宆偐傜敳偗偵偔偄丅
丂丂

丂丂乮俀乯丂嶰儓僂壔傾儞僠儌儞丗丂乮桳撆乯
丂丂嶰儓僂壔傾儞僠儌儞乮俽倐俬3丄俵亖俆侽俀丏俆丄倣倫丏侾俈侾亷丄兿係丏俋俀乯偼丄僥儖儖乚價僗儅僗宯 儁儖僠僃慺巕偺僪乕僾偵梡偄傜傟傞丅
丂丂傾儞僠儌儞暡枛乮Sb丄俋俋丏俋俋俋亾丄M亖侾俀侾丏俉丄 棻忬偺傕偺偼 乮偱偒傟偽乯傔偺偆擕敨偱嵱偔乯 栺侾丏俀倗乮夁忚検乯丄 儓僂慺乮俬丄俵亖侾俀俇丏俋乯 侾丏俆倗 傪丄侾侽侽倣倢暯掙僼儔僗僐偵擖傟丄儀儞僛儞乮俠6俫6丄倐倫丏俉侽丏侾亷乯 栺俉侽倣倢傪壛偊偰丄帪乆壛壏偟側偑傜 傛偔怳傝崿偤偰丄傾儞僠儌儞傪梟偐偡丅丂塼偺怓偑墿怓偵側偭偨傜丄擬偄偆偪偵忋悷傒傪嶰妏僼儔僗僐偵擖傟偰曻椻偡傞偲丄儀儞僛儞梟塼偐傜 僆儗儞僕怓偺斅忬偺寢徎偑弌偰偔傞偺偱丄傠夁偟偰廤傔丄姡憞偡傞丅 乮儀儞僛儞堷壩拲堄乯
丂丂丂丂丂丂丂丂丂俀 Sb丂亄丂俁 I2丂仺丂俀 SbI3伀
丂

丂丂俆丏丂價僗儅僗偺幚尡丗
丂丂價僗儅僗乮憮墧乮偦偆偊傫乯丄Bi丄M=俀侽俋丏侽丄倣倫丏俀俈侾丏係亷丄尨巕斣崋俉俁偱丄曻幩惈尦慺乯偼丄愒傒偑偐偭偨嬧敀怓乮價僗儅僗扨懱偺怓乯偺廮傜偐偔傕傠偄嬥懏偱丄掅梈揰崌嬥偺嵽椏偲偟偰梡偄傜傟偰偄傞丅 斾妑揑弮搙偺崅偄傕偺偑嬻婥拞偱嬅屌偡傞偲偒丄僺儔儈僢僪忬偵廳側偭偨巐妏偄寢徎乮奫徎乯偑尰傟丄巁壔旐枌偺偨傔丄岝偺姳徛偵傛傞峔憿怓傪掓偡傞丅乮憮墧乮偦偆偊傫乯偺柤慜偺桼棃乯丂價僗儅僗偼忢壏偱斀帴惈懱偱偁傝丄悈柺偵晜偐傋偰嫮椡側帴愇傪嬤偯偗傞偲斀敪偟偰墦偞偐傞丅
丂丂傑偨丄俀侽侽俁擭偵應掕偝傟偨敿尭婜乮旕忢偵挿偄 侾丏俋亊侾侽19擭乯偵傛傝丄 209Bi 偼 兛曵夡偡傞曻幩惈尦慺偱偁傞偙偲偑敾柧偟丄嵟廳偺埨掕摨埵尦慺偼墧乮208Pb乯偵忳傞偙偲偵側偭偨丅
丂丂僥儖儖偲偺崌嬥偼丄擬揹慺巕乮儁儖僠僃慺巕乯偲偟偰 敿摫懱摍偺椻媝梡偵梡偄傜傟偰偄傞丅 傑偨丄價僗儅僗宯崅壏挻揱摫暔幙偼丄塼懱拏慺偺壏搙偱埨掕偟偨挻揱摫懱偱偁傞丅
丂丂價僗儅僗偼 廳嬥懏偱偁傞偵傕偐偐傢傜偢丄傎傏撆惈偺柍偄嬥懏丄傑偨壔崌暔偱偁傝丄堛栻梡偵傕梡偄傜傟偰偄傞丅丂巁壔價僗儅僗乮Bi2O3乯丄師徤巁價僗儅僗偼惍挵嵻丒巭郻栻乮壓棢巭傔乯側偳偵梡偄傜傟傞丅丂價僗儅僗偼擹徤巁偵梟偗丄徤巁價僗儅僗乮Bi乮NO3乯3丒俆H2O乯傪寢徎偡傞丅 師徤巁價僗儅僗偼丄徤巁價僗儅僗 侾丗 悈 係 傪暒摣偝偣 惗偠傞捑揳傪廤傔姡憞偝偣偨傕偺丅乮Bi5O乮OH乯9乮NO3乯4丄悈偵晄梟偺敀怓暡枛乯
丂丂乮侾乯丂掅梈揰崌嬥丗
丂丂嘆丂僀儞僕僂儉傑偱娷傓掅梈揰崌嬥乮堈梈崌嬥乯偱嵟掅梈揰乮嫟徎揰亖係俇丏俈亷乯偺傕偺傪嶌惉偟偨丅乮仺丂嬥懏偺幚尡侾丏乯
丂丂價僗儅僗係俆丏俇倗丄墧俀俁丏侾倗丄庎 俉丏俆倗丄僇僪儈僂儉 俆丏係倗傪愭偵梟梈偟丄壩傪巭傔偰偐傜 僀儞僕僂儉侾俋丏俆倗傪壛偊偨丅 梈揰偑掅偄偺偱丄曻椻偱偼嬅屌偟偵偔偄丅 峝偝偼偁傞丅

